在药品专利链接制度中提高生物药保护力度的研究*
北京世宁律师事务所 刘永全、李洁
2020年10月17日第十三届全国人民代表大会常务委员会第二十二次会议通过《关于修改〈中华人民共和国专利法〉的决定》,对《中华人民共和国专利法》进行了第四次修正,修正后的《中华人民共和国专利法》第七十六条涉及药品专利链接制度,具体内容如下:
“药品上市审评审批过程中,药品上市许可申请人与有关专利权人或者利害关系人,因申请注册的药品相关的专利权产生纠纷的,相关当事人可以向人民法院起诉,请求就申请注册的药品相关技术方案是否落入他人药品专利权保护范围作出判决。国务院药品监督管理部门在规定的期限内,可以根据人民法院生效裁判作出是否暂停批准相关药品上市的决定。”
为配合药品专利链接制度的实施,国家药监局、国家知识产权局发布了《药品专利纠纷早期解决机制实施办法(试行)(征求意见稿)》(以下称《征求意见稿》),其中,对于化学药、生物药和中药采用了不同的处理方法。对于化学药,《征求意见稿》采用了比较完整的专利链接制度。其中涉及的专利类型包括化合物专利、组合物专利以及医药用途专利,同时,设置了“等待期”。而对于生物药,则是一种不完整的专利链接制度。在专利类型上,生物药仅有序列结构专利被纳入专利链接,同时生物药没有设置等待期。
将生物药纳入专利链接制度并提供适当强度保护,对我国生物制药产业的发展、药物的可及性等均具有重要意义,也是业界引起广泛关注和讨论的问题。本文希望通过对以下问题的研究,对这一问题提供一些浅见。
首先,如何解读《征求意见稿》中与生物药有关的内容。
其次,从美国的立法过程看,先将化学药纳入专利链接制度,多年之后才为生物药设计了一种特殊的专利链接制度,即“专利舞蹈”。我国是否也应当采用分步走的策略。例如在现阶段,先为生物药提供一种不完整的专利链接制度,待执行一段时间后,再根据情况确定是否提供一种完整的专利链接制度。
其三,如果像化学药那样,也将生物药纳入完整的专利链接制度,是否会引发大规模诉讼并对我国的生物药产业产生巨大冲击。
其四,生物药的侵权判断是否更为复杂,裁判机关是否具备审理此类案件的能力。
其五,美国的“专利舞蹈”提示,应当强化对生物药的保护。
基于对上述5个问题的研究,本文建议将生物药和化学药同等对待,适用完整的专利链接制度。
一、《征求意见稿》将生物药和化学药区别对待,对生物药的保护弱于对化学药的保护。
2020年9月11日,国家药监局、国家知识产权局发布了《药品专利纠纷早期解决机制实施办法(试行)(征求意见稿)》。该《征求意见稿》明确了对化学药和生物药区别对待的情形。
关于等待期,《征求意见稿》第八条规定了以下内容:
“【等待期】自人民法院或者国务院专利行政部门立案或者受理之日起,国务院药品监督管理部门对‘化学仿制药’注册申请设置9个月的等待期,等待期内国家药品审评机构不停止技术审评。”
基于上述内容,只有化学药才涉及“等待期”,生物药和中药不涉及等待期。
关于这一问题,《征求意见稿》第十三条进一步明确指出,生物药和中药是不涉及等待期的,第十三条的内容如下:
“【分类处理】对生物类似药和中药同名同方药注册申请,‘国务院药品监督管理部门依据技术审评结论,直接作出是否批准上市的决定’。如专利权人或者利害关系人自国家药品审评机构公示药品上市许可申请之日起45日内,就申请上市药品的相关技术方案是否落入相关专利权保护范围向人民法院提起诉讼或者向国务院专利行政部门申请行政裁决,且药品行政审批程序完成前人民法院或者国务院专利行政部门确认相关技术方案落入专利权保护范围的,对技术审评通过,国务院药品监督管理部门作出批准上市决定的,应当注明在专利权期限届满后方可上市销售。”
基于上述内容,对于生物类似药,“国务院药品监督管理部门依据技术审评结论,‘直接’作出是否批准上市的决定”,中间没有设置“等待期”这样一个环节。
除了没有等待期之外,可以纳入专利链接体系的专利类型也不同。对于化学药而言,相关的专利类型包括化合物专利、组合物专利和医药用途专利。具体规定在《征求意见稿》第五条,内容如下:
“【平台登记专利类型】化学药品注册申请人提交药品上市许可申请时,可在中国上市药品专利信息登记平台登记‘药物活性成分化合物专利’、‘含活性成分的药物组合物专利’、‘医药用途专利’。”
而对于生物药而言,却仅有一种专利类型,即,序列结构专利。具体规定在《征求意见稿》第十二条,内容如下:
“【分类处理】生物制品、中药上市注册申请人,按照本办法第二、三、四、六、七条,进行相关专利信息登记、声明等。‘生物制品可登记序列结构专利’,中药可登记中药组合物专利、中药提取物专利、医药用途专利。”
上述内容显示,生物药将被纳入一种不完整的专利链接制度。一方面,生物药的专利类型仅被限制在序列结构专利,不涉及组合物专利和医药用途专利。另一方面,生物药没有等待期,即便存在诉讼,一旦生物类似药通过了技术审评,国务院药品监督管理部门无需等待诉讼结果,可以“直接”作出是否批准上市的决定。
对于生物药而言,唯一的好处是,可以自国家药品审评机构公示药品上市许可申请之日起45日内,向人民法院提起诉讼或者向国务院专利行政部门申请行政裁决。
目前的这种做法,是将生物药和化学药区别对待。对化学药提供传统的,比较完整的药品专利链接制度体系。而对生物药,则提供一种简化的药品专利链接制度体系。总而言之,对生物药的保护弱于对化学药的保护。
二、我国是否需要采用分步走的策略,对化学药和生物药区别对待。
美国作为专利链接制度的先行者,于1984年通过了《Waxman-Hatch法案》,建立了涵盖化学药品的专利链接制度。26年之后,美国才于2010年通过了《生物制品价格竞争与创新法案(Biologics Price Competition and Innovation Act, BPCIA)》,建立了针对生物药的专利链接制度(专利舞蹈制度)。
一种观点认为,中国也应当像美国那样,采用分步走的策略,先在本次修法过程中为化学药建立完整的专利链接制度,而对于生物药,则可以降低保护力度,例如不设置等待期以及限制专利类型。
笔者认为,基于生物药的发展历史和现状,应当及时将生物药和化学药一起纳入到统一的专利链接制度中,而不应区别对待。
美国于1984年通过了《Waxman-Hatch法案》时,生物药还没有几个,所以当时生物药的问题根本没有引起重视。全球生物新药研发根据结构类别看大致分为四个阶段 1:
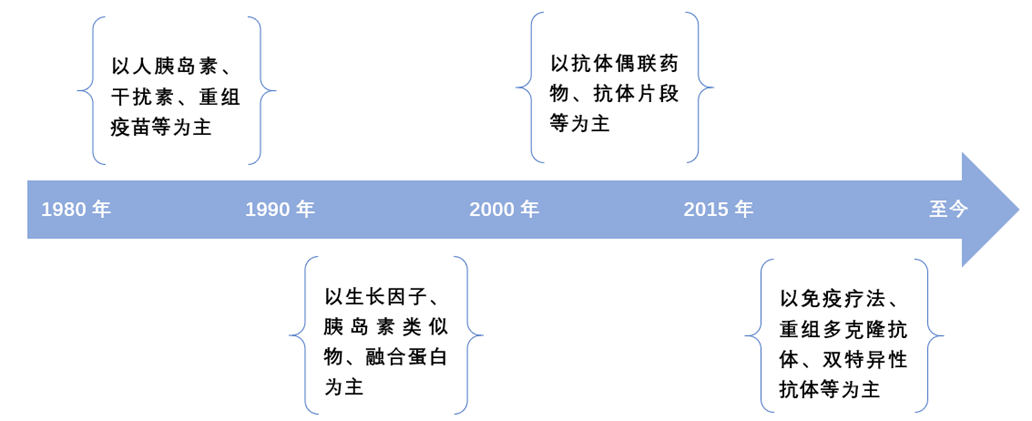
从上图可以看出,上世纪八九十年代是生物药发展的起始阶段,药品数量很少,因此,美国在1984年通过了《Waxman-Hatch法案》时,没有关注生物药的问题。
2000年之后,抗体类药物大量出现,2015年之后,抗体类药物种类更多,而且出现了免疫疗法、细胞疗法等多种新的治疗途径和方法。迄今为止,已发展和建立了近40种生物药的INN(国际非专利名;International Nonproprietary Names)药学分类,累计超过1300个生物药物2 。
同时,生物药在重磅药物中的占比越来越大。根据各家生物制药公司2019财报披露的产品销售数据, 销售额前100位的药品中小分子药物共54个,销售收入占比46%。单抗/重组蛋白类大分子药物共40个,销售收入占比49%。如果把范围缩小到前10位,销售收入总计908.01亿美元,其中小分子药物共4个,销售收入占比39%,单抗/重组蛋白类大分子药物共6个,销售收入占比达到了61% 3。
毫无疑问,生物产业已经逐渐成为资金、技术和创新集中的领域,越来越多的重磅药物来自于生物药。生物药物在市场上逐渐反超化学药物,成为了全球药物市场最大的支柱领域。
中国也把生物药物作为了战略性新兴产业的主攻方向。“十二五”期间,国家将单克隆抗体、新型疫苗、重组蛋白等生物药作为重点扶持对象。“十三五”规划中提出的“推进健康中国建设”的八大措施中,生物医药更是重中之重。2016年国家出台了《2016~2020年生物医药产业振兴规划》,要求加快推动生物产业作为国民经济的支柱产业,加快生物产业与其他产业融合,加快靶向药物、免疫疗法等技术发展。根据CFDA官方和药渡数据库显示,从2001年开始,截止至2018年8月,目前CFDA一共批准了32个中国一类生物新药4 。
基于生物药的上述发展情况,为了促进和保护生物药的创新发展,我国应当将生物药和化学药一样纳入完整的专利链接制度体系,不应当区别对待,尤其不应当弱化对生物药的保护。
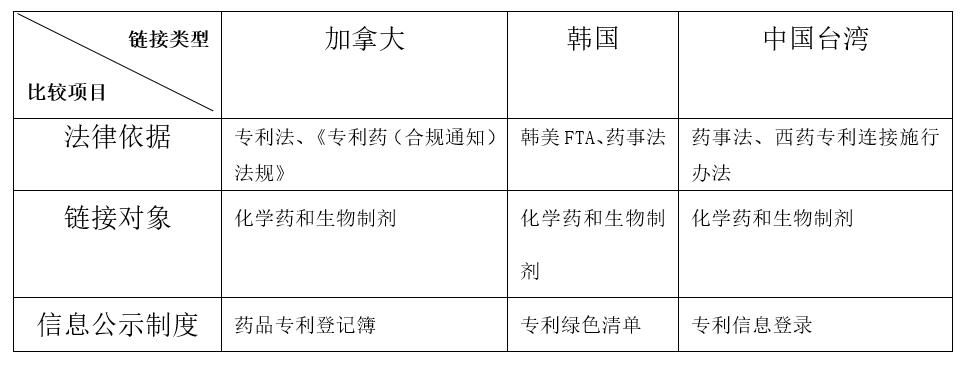
另外,从多个国家和地区引入专利链接的情况看,都将生物药和化学药统一纳入到了专利链接制度体系中,并未针对生物药专门设计一个简化的专利链接制度。如下表所示:
三、如果将生物药纳入完整的专利链接制度,是否会引发大规模诉讼并对我国的生物药产业产生巨大冲击。
为了回答这一问题,首先需要了解我国目前与生物药有关的专利侵权诉讼情况。我国目前涉及生物药的侵权诉讼是非常罕见的,很难检索到这方面的案例。这说明与生物药有关的专利侵权案件本身的基础水平是很低的,即便在专利链接实施后,也不会出现大量这类案件。
美国自2010年开始实行针对生物药的专利链接制度以来,平均每年新发的相关专利诉讼也只有4件左右。考虑到我国在涉及生物药的专利授权方面采取了更为谨慎的态度,获得授权的生物药专利更少,保护范围更狭窄,专利链接制度引入后,预计每年新发的生物药专利侵权诉讼案件基本会保持在个位数。
其次,生物药领域获得物质专利和适应症专利的难度更高。
化学药的开发,不需要把机理搞的那么清楚,只要化合物有治疗效果就可以。相对来讲会有更多机会找到现有技术中没有记载的具备开发潜力的化合物,从而申请并获得专利(与通信领域、电器领域相比,化药领域的专利已经少的可怜)。
生物药的开发,通常需要先研究机理,或者先获得一些线索。例如,其中一部分药物就是存在于人体或动物体内的物质,在该物质被最终开发成为药品之前,甚至在人们发现该物质具有药用潜力之前,通常已经有很多研究报道过这种物质及其用途,从而导致更难获得物质专利和用途专利。
以胰岛素为例:1921年,加拿大医生Frederick G. Banting的通过结扎狗的胰腺提取出狗胰岛素,用于治疗糖尿病;此后有牛胰岛素,猪胰岛素;1963年,提取得到人胰岛素。此时,仅是从人体组织上提取到少量胰岛素,不可能大规模生产和真正成为药物;1974年,从氨基酸化学合成人胰岛素;1981年,通过基因工程技术生产人胰岛素。
上述过程显示,从发现胰岛素,到最终能够较大规模生产和成为药物经历了将近60年时间,从而导致很难取得物质专利和用途专利。
由于生物药的上述研发特点,导致其专利数量很少,尤其是物质专利和用途专利。
其三,与化学药相比,生物药的物质专利保护范围通常更为狭窄,也更容易进行规避设计。
提起化学药的物质专利,自然会想到著名的马库什权利要求。此种权利要求的特点在于,其具有一个化合物通式,该通式上的一些基团具有多种选择5 。当存在多个这种基团的时候,这些基团的排列组合将产生成千上万种化合物分子,因此其保护范围非常大,导致规避设计比较困难。如果进行规避设计,通常会导致化合物的效果变差。
化学药方面的例子包括罗氏公司原研的厄洛替尼和贝达公司在厄洛替尼结构基础上开发的埃克替尼。厄洛替尼是罗氏公司开发的一种靶向治疗药物,它是一种小分子化合物,可特异性地针对肿瘤细胞作用,抑制肿瘤的形成和生长6 。贝达公司在厄洛替尼结构基础上,将其侧链进行闭环,母核结构没有改变,开发了埃克替尼。通过这种改造,绕开了专利保护,但是也导致埃克替尼活性有所下降。厄洛替尼每天一次(150mg/次)变成了埃克替尼的每天3次(125mg/次),药物剂量提高了一倍以上才能达到原研药的水平7 。
生物药方面,通常需要限定到非常具体的序列(氨基酸序列或者DNA(基因)序列)才会获得专利授权,其涵盖的生物大分子具体明确,通常不允许以一个或者几个具体的序列为基础进行上位概括。这种情况导致生物药的物质专利保护范围相对较小。另外,由于生物药是大分子药物,更有可能通过改变局部的序列,获得疗效与原研药基本相同甚至更好的生物分子。这种情况也导致生物药更容易成功地进行规避设计。
生物药方面的例子包括阿柏西普和康柏西普。阿柏西普是由美国再生元公司开发的眼科单抗药物,用于治疗黄斑变性等眼科疾病。康柏西普是成都康弘开发的一类生物药,在阿柏西普分子的基础上增加了VEGFR2第4个结构域的部分序列,两者临床疗效没有显著差异。同时在给药方案上,康柏西普在阿柏西普基础上进行了优化,达到了更少的给药频率而维持相似的临床疗效8 。
生物药的一个特点,就是通常针对一个重要的治疗靶点,有多个相似的药物同时开发以及在市场上同时并存。以PD-1抑制剂为例,存在多个获批上市的药物。包括BMS(百时美施贵宝)的Nivolumab(商品名Opdivo,简称O药,也叫纳武单抗)、MDS(默沙东)的Pembrolizumab(商品名Keytruda,简称K药,也叫派姆单抗)。除上述两种进口药物外,2018年12月,首个国产PD-1抗体药物信迪利单抗注射液获批上市。2019年12月,国产PD-1抗体药物—百泽安(通用名:替雷利珠单抗注射液)获批上市9 。
上述情况说明,生物药的研发更容易突破专利壁垒,出现多种药物共存的局面。
综上所述,如果将生物药纳入完整的专利链接制度,不会引发大规模专利诉讼,也不会对我国的生物药产业产生巨大冲击。
四、生物药的侵权判断是否更为复杂,裁判机关是否具备审理此类案件的能力。
本文讨论的侵权判断,应当是由于专利链接而引起的专利侵权纠纷中的侵权判断。基于专利链接这样一个前提,侵权判断过程会相对简单。
设立专利链接制度的目的,在于通过建立早期解决机制,力争在仿制药上市之前,解决原研药和仿制药之间的纠纷。生物类似药(生物仿制药)的研发过程本身决定了其侵权判断相对简单。
首先,要避免将普通专利侵权判断中“类似”概念应用到专利链接引起的专利侵权纠纷中。普通的专利侵权判断中虽然没有明确提出“类似”这样一个概念,但人们在对是否构成等同侵权这一问题进行判断的时候,会自然想到被控侵权产品是否与专利的技术方案类似。也就是说,普通侵权案件中,“类似”这一概念更多的与等同侵权相关联,而等同侵权的判断涉及很多规则,过程相对复杂。
生物类似药是国家药监部门对申报药品的分类。生物药通常分为三类,即生物创新药、生物改良药和生物类似药。国家食品药品监督管理总局于2015年3月发布的《生物类似药研发与评价技术指导原则(试行)》,对于生物类似药有以下定义和说明:
“本指导原则所述生物类似药是指:在质量、安全性和有效性方面与已获准注册的参照药具有相似性的治疗用生物制品。”
“生物类似药候选药物的氨基酸序列原则上应与参照药相同。对研发过程中采用不同于参照药所用的宿主细胞、表达体系等的,需进行充分研究。”
从上述内容看出,《技术指导原则》明确要求生物类似药候选药物的氨基酸序列原则上应与参照药(原研药)相同。如果原研药的氨基酸序列已经被专利保护,则依据生物类似药的药品申报资料就可以直接做出是否侵权的判断。
在药品申报程序中,通常要求生物仿制药与原研药品在氨基酸序列等方面高度一致,并且要求生物仿制药仅能在原研药的适应症范围内选择适应症。因此,如果发生了原研药厂与生物仿制药厂之间的专利纠纷,则侵权对比很容易进行。
由此可见,如果因专利链接制度的设立而引发与生物仿制药有关的专利侵权诉讼,相应的专利侵权判断相对于普通专利侵权案件更为简单,裁判机关完全具备审理此类案件的能力。
五、美国的“专利舞蹈”制度的启示。
美国的《生物制品价格竞争与创新法案》(BPCIA)所设立的“专利舞蹈”制度,是针对生物药的特点设计的。
首先,考虑到生物药领域获得物质专利和用途专利比较困难,以及同时有大量的制备方法专利存在,因此,美国的专利舞蹈制度中,除了涉及物质专利、用途专利外,还包括制备方法专利。
其次,由于制备方法专利的存在,导致侵权判断比较复杂。专利舞蹈制度的一个重要内容,就是为原研药厂和仿制药厂设计了一个沟通的机制和程序。
其中要求,生物类似药申请被FDA受理后的20天内,申请人应当向生物药原研企业提供一份申请的副本,并披露生物类似药的生产流程,而在收到副本后的60天内,原研公司应当向申请人提供一份其认为被侵权的专利清单,并指出可以许可给生物类似药申请人的专利。
生物类似药申请人在收到专利清单的60天内提供一份声明,详细说明为何专利清单中所列专利无效、不可执行或不被侵权,或者申请人声明在专利保护期届满前不会销售该产品。收到声明后,生物药原研企业应当在60天内详细说明所列专利为何有效、可执行且被侵权。充分完成信息交换可能需要半年以上的时间,达成一致后,双方即可针对清单中所列专利展开诉讼10 。
上述过程如下图所示:
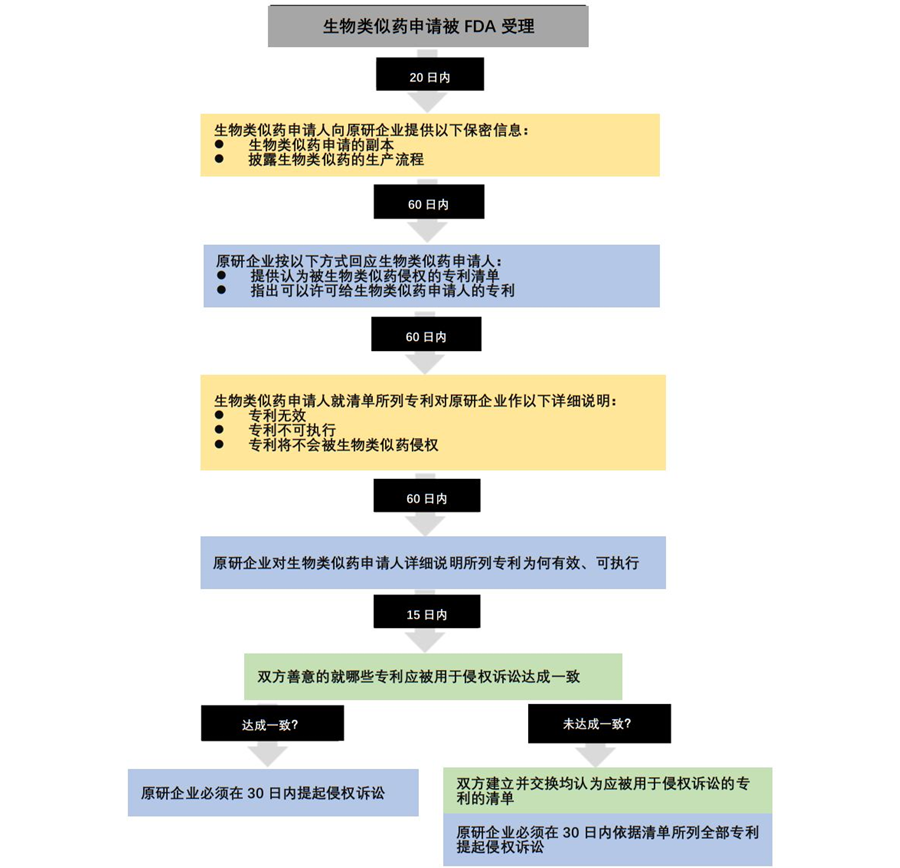
由此可见,美国为了加强对生物药的保护,根据生物药的特点,为其量身定制了“专利舞蹈”制度。其中值得借鉴和思考的是,美国的“专利舞蹈”制度考虑到了生物药获得物质专利和用途专利更为困难的情况,为了给生物药提供适当强度的保护,将专利类型扩展到了制备方法专利。
我国在将生物药纳入专利链接制度体系时,虽然不见得一定要包括制备方法专利,但是至少应当涵盖与化学药同样的专利类型。不应当将生物药的专利范围,仅限制到序列结构专利。
综上所述,建议明确将生物药和化学药一起纳入完整的专利链接制度体系。不仅可以表明中国对生物药加强专利保护的态度,吸引更多原研药进入中国市场,还可促进中国原研药和仿制药的发展,提高药品的可及性。同时,专利链接制度对产业的负面影响很小,不会出现大规模诉讼案件,且法院和行政机关完全有能力审理此类案件。为实现上述目的,建议在《药品专利纠纷早期解决机制实施办法(试行)(征求意见稿)》中,不再进行“分类处理”。可以统一规定生物药、化学药的专利类型均包括化合物专利、组合物专利和用途专利,以及统一规定同样的“等待期”。
注释:
* 本文的主要内容来自作者承担的北京务实知识产权发展中心的子课题“关于如何将生物药纳入药品专利链接制度体系的研究”,撰写过程得到了包括北京务实知识产权发展中心主任程永顺等多位专家的指导和建议,在此一并致谢。
[1] 来源:药渡 2018-10-31:https://med.sina.com/article_detail_103_2_55044.html
[2] 中国生物工程杂质,2020,40(1/2),曹萌等,从国际非专利名称纵观全球生物药发展
[3] 医药魔方,2019年全球药品销售额TOP100:https://mp.weixin.qq.com/s/TMuQwKJe_m79lUeEwS5Uwg
[4] 药渡 2018-10-31:https://med.sina.com/article_detail_103_2_55044.html
[5] 专利审查指南,2010年版,第二部分第十章,287-291
[6] https://baike.baidu.com/item/%E5%8E%84%E6%B4%9B%E6%9B%BF%E5%B0%BC/7591659#16
[7] 药渡 2018-10-31:https://med.sina.com/article_detail_103_2_55044.html
[8] 药渡 2018-10-31:https://med.sina.com/article_detail_103_2_55044.html
[9] 百度百科,PD-1,https://baike.baidu.com/item/PD-1/15285259?fr=aladdin
[10] 星条旗下的宝藏:美国生物类似药概览,Nesta,医药魔方,2019-03-18