在藥品專利鏈接制度中提高生物藥保護力度的研究*
北京世寧律師事務所 劉永全、李潔
2020年10月17日第十三屆全國人民代表大會常務委員會第二十二次會議通過《關於修改〈中華人民共和國專利法〉的決定》,對《中華人民共和國專利法》進行了第四次修正,修正後的《中華人民共和國專利法》第七十六條涉及藥品專利鏈接制度,具體內容如下:
“藥品上市審評審批過程中,藥品上市許可申請人與有關專利權人或者利害關系人,因申請註冊的藥品相關的專利權產生糾紛的,相關當事人可以向人民法院起訴,請求就申請註冊的藥品相關技術方案是否落入他人藥品專利權保護範圍作出判決。國務院藥品監督管理部門在規定的期限內,可以根據人民法院生效裁判作出是否暫停批準相關藥品上市的決定。”
為配合藥品專利鏈接制度的實施,國家藥監局、國家知識產權局發布了《藥品專利糾紛早期解決機制實施辦法(試行)(征求意見稿)》(以下稱《征求意見稿》),其中,對於化學藥、生物藥和中藥采用了不同的處理方法。對於化學藥,《征求意見稿》采用了比較完整的專利鏈接制度。其中涉及的專利類型包括化合物專利、組合物專利以及醫藥用途專利,同時,設置了“等待期”。而對於生物藥,則是壹種不完整的專利鏈接制度。在專利類型上,生物藥僅有序列結構專利被納入專利鏈接,同時生物藥沒有設置等待期。
將生物藥納入專利鏈接制度並提供適當強度保護,對我國生物制藥產業的發展、藥物的可及性等均具有重要意義,也是業界引起廣泛關註和討論的問題。本文希望通過對以下問題的研究,對這壹問題提供壹些淺見。
首先,如何解讀《征求意見稿》中與生物藥有關的內容。
其次,從美國的立法過程看,先將化學藥納入專利鏈接制度,多年之後才為生物藥設計了壹種特殊的專利鏈接制度,即“專利舞蹈”。我國是否也應當采用分步走的策略。例如在現階段,先為生物藥提供壹種不完整的專利鏈接制度,待執行壹段時間後,再根據情況確定是否提供壹種完整的專利鏈接制度。
其三,如果像化學藥那樣,也將生物藥納入完整的專利鏈接制度,是否會引發大規模訴訟並對我國的生物藥產業產生巨大沖擊。
其四,生物藥的侵權判斷是否更為復雜,裁判機關是否具備審理此類案件的能力。
其五,美國的“專利舞蹈”提示,應當強化對生物藥的保護。
基於對上述5個問題的研究,本文建議將生物藥和化學藥同等對待,適用完整的專利鏈接制度。
壹、《征求意見稿》將生物藥和化學藥區別對待,對生物藥的保護弱於對化學藥的保護。
2020年9月11日,國家藥監局、國家知識產權局發布了《藥品專利糾紛早期解決機制實施辦法(試行)(征求意見稿)》。該《征求意見稿》明確了對化學藥和生物藥區別對待的情形。
關於等待期,《征求意見稿》第八條規定了以下內容:
“【等待期】自人民法院或者國務院專利行政部門立案或者受理之日起,國務院藥品監督管理部門對‘化學仿制藥’註冊申請設置9個月的等待期,等待期內國家藥品審評機構不停止技術審評。”
基於上述內容,只有化學藥才涉及“等待期”,生物藥和中藥不涉及等待期。
關於這壹問題,《征求意見稿》第十三條進壹步明確指出,生物藥和中藥是不涉及等待期的,第十三條的內容如下:
“【分類處理】對生物類似藥和中藥同名同方藥註冊申請,‘國務院藥品監督管理部門依據技術審評結論,直接作出是否批準上市的決定’。如專利權人或者利害關系人自國家藥品審評機構公示藥品上市許可申請之日起45日內,就申請上市藥品的相關技術方案是否落入相關專利權保護範圍向人民法院提起訴訟或者向國務院專利行政部門申請行政裁決,且藥品行政審批程序完成前人民法院或者國務院專利行政部門確認相關技術方案落入專利權保護範圍的,對技術審評通過,國務院藥品監督管理部門作出批準上市決定的,應當註明在專利權期限屆滿後方可上市銷售。”
基於上述內容,對於生物類似藥,“國務院藥品監督管理部門依據技術審評結論,‘直接’作出是否批準上市的決定”,中間沒有設置“等待期”這樣壹個環節。
除了沒有等待期之外,可以納入專利鏈接體系的專利類型也不同。對於化學藥而言,相關的專利類型包括化合物專利、組合物專利和醫藥用途專利。具體規定在《征求意見稿》第五條,內容如下:
“【平臺登記專利類型】化學藥品註冊申請人提交藥品上市許可申請時,可在中國上市藥品專利信息登記平臺登記‘藥物活性成分化合物專利’、‘含活性成分的藥物組合物專利’、‘醫藥用途專利’。”
而對於生物藥而言,卻僅有壹種專利類型,即,序列結構專利。具體規定在《征求意見稿》第十二條,內容如下:
“【分類處理】生物制品、中藥上市註冊申請人,按照本辦法第二、三、四、六、七條,進行相關專利信息登記、聲明等。‘生物制品可登記序列結構專利’,中藥可登記中藥組合物專利、中藥提取物專利、醫藥用途專利。”
上述內容顯示,生物藥將被納入壹種不完整的專利鏈接制度。壹方面,生物藥的專利類型僅被限制在序列結構專利,不涉及組合物專利和醫藥用途專利。另壹方面,生物藥沒有等待期,即便存在訴訟,壹旦生物類似藥通過了技術審評,國務院藥品監督管理部門無需等待訴訟結果,可以“直接”作出是否批準上市的決定。
對於生物藥而言,唯壹的好處是,可以自國家藥品審評機構公示藥品上市許可申請之日起45日內,向人民法院提起訴訟或者向國務院專利行政部門申請行政裁決。
目前的這種做法,是將生物藥和化學藥區別對待。對化學藥提供傳統的,比較完整的藥品專利鏈接制度體系。而對生物藥,則提供壹種簡化的藥品專利鏈接制度體系。總而言之,對生物藥的保護弱於對化學藥的保護。
二、我國是否需要采用分步走的策略,對化學藥和生物藥區別對待。
美國作為專利鏈接制度的先行者,於1984年通過了《Waxman-Hatch法案》,建立了涵蓋化學藥品的專利鏈接制度。26年之後,美國才於2010年通過了《生物制品價格競爭與創新法案(Biologics Price Competition and Innovation Act, BPCIA)》,建立了針對生物藥的專利鏈接制度(專利舞蹈制度)。
壹種觀點認為,中國也應當像美國那樣,采用分步走的策略,先在本次修法過程中為化學藥建立完整的專利鏈接制度,而對於生物藥,則可以降低保護力度,例如不設置等待期以及限制專利類型。
筆者認為,基於生物藥的發展歷史和現狀,應當及時將生物藥和化學藥壹起納入到統壹的專利鏈接制度中,而不應區別對待。
美國於1984年通過了《Waxman-Hatch法案》時,生物藥還沒有幾個,所以當時生物藥的問題根本沒有引起重視。全球生物新藥研發根據結構類別看大致分為四個階段 1:
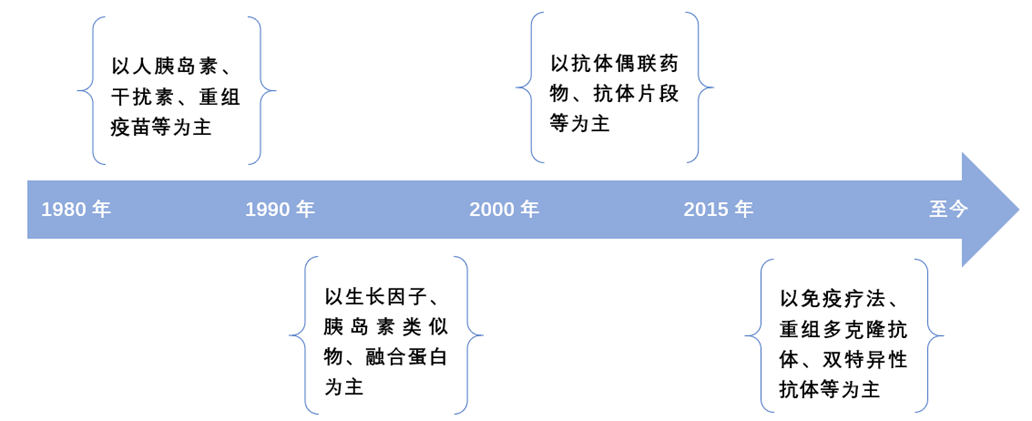
從上圖可以看出,上世紀八九十年代是生物藥發展的起始階段,藥品數量很少,因此,美國在1984年通過了《Waxman-Hatch法案》時,沒有關註生物藥的問題。
2000年之後,抗體類藥物大量出現,2015年之後,抗體類藥物種類更多,而且出現了免疫療法、細胞療法等多種新的治療途徑和方法。迄今為止,已發展和建立了近40種生物藥的INN(國際非專利名;International Nonproprietary Names)藥學分類,累計超過1300個生物藥物2 。
同時,生物藥在重磅藥物中的占比越來越大。根據各家生物制藥公司2019財報披露的產品銷售數據, 銷售額前100位的藥品中小分子藥物共54個,銷售收入占比46%。單抗/重組蛋白類大分子藥物共40個,銷售收入占比49%。如果把範圍縮小到前10位,銷售收入總計908.01億美元,其中小分子藥物共4個,銷售收入占比39%,單抗/重組蛋白類大分子藥物共6個,銷售收入占比達到了61% 3。
毫無疑問,生物產業已經逐漸成為資金、技術和創新集中的領域,越來越多的重磅藥物來自於生物藥。生物藥物在市場上逐漸反超化學藥物,成為了全球藥物市場最大的支柱領域。
中國也把生物藥物作為了戰略性新興產業的主攻方向。“十二五”期間,國家將單克隆抗體、新型疫苗、重組蛋白等生物藥作為重點扶持對象。“十三五”規劃中提出的“推進健康中國建設”的八大措施中,生物醫藥更是重中之重。2016年國家出臺了《2016~2020年生物醫藥產業振興規劃》,要求加快推動生物產業作為國民經濟的支柱產業,加快生物產業與其他產業融合,加快靶向藥物、免疫療法等技術發展。根據CFDA官方和藥渡數據庫顯示,從2001年開始,截止至2018年8月,目前CFDA壹共批準了32個中國壹類生物新藥4 。
基於生物藥的上述發展情況,為了促進和保護生物藥的創新發展,我國應當將生物藥和化學藥壹樣納入完整的專利鏈接制度體系,不應當區別對待,尤其不應當弱化對生物藥的保護。
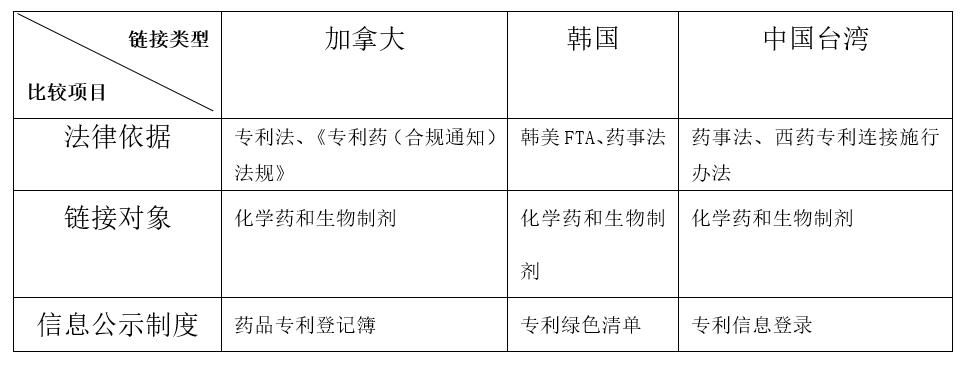
另外,從多個國家和地區引入專利鏈接的情況看,都將生物藥和化學藥統壹納入到了專利鏈接制度體系中,並未針對生物藥專門設計壹個簡化的專利鏈接制度。如下表所示:
三、如果將生物藥納入完整的專利鏈接制度,是否會引發大規模訴訟並對我國的生物藥產業產生巨大沖擊。
為了回答這壹問題,首先需要了解我國目前與生物藥有關的專利侵權訴訟情況。我國目前涉及生物藥的侵權訴訟是非常罕見的,很難檢索到這方面的案例。這說明與生物藥有關的專利侵權案件本身的基礎水平是很低的,即便在專利鏈接實施後,也不會出現大量這類案件。
美國自2010年開始實行針對生物藥的專利鏈接制度以來,平均每年新發的相關專利訴訟也只有4件左右。考慮到我國在涉及生物藥的專利授權方面采取了更為謹慎的態度,獲得授權的生物藥專利更少,保護範圍更狹窄,專利鏈接制度引入後,預計每年新發的生物藥專利侵權訴訟案件基本會保持在個位數。
其次,生物藥領域獲得物質專利和適應癥專利的難度更高。
化學藥的開發,不需要把機理搞的那麽清楚,只要化合物有治療效果就可以。相對來講會有更多機會找到現有技術中沒有記載的具備開發潛力的化合物,從而申請並獲得專利(與通信領域、電器領域相比,化藥領域的專利已經少的可憐)。
生物藥的開發,通常需要先研究機理,或者先獲得壹些線索。例如,其中壹部分藥物就是存在於人體或動物體內的物質,在該物質被最終開發成為藥品之前,甚至在人們發現該物質具有藥用潛力之前,通常已經有很多研究報道過這種物質及其用途,從而導致更難獲得物質專利和用途專利。
以胰島素為例:1921年,加拿大醫生Frederick G. Banting的通過結紮狗的胰腺提取出狗胰島素,用於治療糖尿病;此後有牛胰島素,豬胰島素;1963年,提取得到人胰島素。此時,僅是從人體組織上提取到少量胰島素,不可能大規模生產和真正成為藥物;1974年,從氨基酸化學合成人胰島素;1981年,通過基因工程技術生產人胰島素。
上述過程顯示,從發現胰島素,到最終能夠較大規模生產和成為藥物經歷了將近60年時間,從而導致很難取得物質專利和用途專利。
由於生物藥的上述研發特點,導致其專利數量很少,尤其是物質專利和用途專利。
其三,與化學藥相比,生物藥的物質專利保護範圍通常更為狹窄,也更容易進行規避設計。
提起化學藥的物質專利,自然會想到著名的馬庫什權利要求。此種權利要求的特點在於,其具有壹個化合物通式,該通式上的壹些基團具有多種選擇5 。當存在多個這種基團的時候,這些基團的排列組合將產生成千上萬種化合物分子,因此其保護範圍非常大,導致規避設計比較困難。如果進行規避設計,通常會導致化合物的效果變差。
化學藥方面的例子包括羅氏公司原研的厄洛替尼和貝達公司在厄洛替尼結構基礎上開發的埃克替尼。厄洛替尼是羅氏公司開發的壹種靶向治療藥物,它是壹種小分子化合物,可特異性地針對腫瘤細胞作用,抑制腫瘤的形成和生長6 。貝達公司在厄洛替尼結構基礎上,將其側鏈進行閉環,母核結構沒有改變,開發了埃克替尼。通過這種改造,繞開了專利保護,但是也導致埃克替尼活性有所下降。厄洛替尼每天壹次(150mg/次)變成了埃克替尼的每天3次(125mg/次),藥物劑量提高了壹倍以上才能達到原研藥的水平7 。
生物藥方面,通常需要限定到非常具體的序列(氨基酸序列或者DNA(基因)序列)才會獲得專利授權,其涵蓋的生物大分子具體明確,通常不允許以壹個或者幾個具體的序列為基礎進行上位概括。這種情況導致生物藥的物質專利保護範圍相對較小。另外,由於生物藥是大分子藥物,更有可能通過改變局部的序列,獲得療效與原研藥基本相同甚至更好的生物分子。這種情況也導致生物藥更容易成功地進行規避設計。
生物藥方面的例子包括阿柏西普和康柏西普。阿柏西普是由美國再生元公司開發的眼科單抗藥物,用於治療黃斑變性等眼科疾病。康柏西普是成都康弘開發的壹類生物藥,在阿柏西普分子的基礎上增加了VEGFR2第4個結構域的部分序列,兩者臨床療效沒有顯著差異。同時在給藥方案上,康柏西普在阿柏西普基礎上進行了優化,達到了更少的給藥頻率而維持相似的臨床療效8 。
生物藥的壹個特點,就是通常針對壹個重要的治療靶點,有多個相似的藥物同時開發以及在市場上同時並存。以PD-1抑制劑為例,存在多個獲批上市的藥物。包括BMS(百時美施貴寶)的Nivolumab(商品名Opdivo,簡稱O藥,也叫納武單抗)、MDS(默沙東)的Pembrolizumab(商品名Keytruda,簡稱K藥,也叫派姆單抗)。除上述兩種進口藥物外,2018年12月,首個國產PD-1抗體藥物信迪利單抗註射液獲批上市。2019年12月,國產PD-1抗體藥物—百澤安(通用名:替雷利珠單抗註射液)獲批上市9 。
上述情況說明,生物藥的研發更容易突破專利壁壘,出現多種藥物共存的局面。
綜上所述,如果將生物藥納入完整的專利鏈接制度,不會引發大規模專利訴訟,也不會對我國的生物藥產業產生巨大沖擊。
四、生物藥的侵權判斷是否更為復雜,裁判機關是否具備審理此類案件的能力。
本文討論的侵權判斷,應當是由於專利鏈接而引起的專利侵權糾紛中的侵權判斷。基於專利鏈接這樣壹個前提,侵權判斷過程會相對簡單。
設立專利鏈接制度的目的,在於通過建立早期解決機制,力爭在仿制藥上市之前,解決原研藥和仿制藥之間的糾紛。生物類似藥(生物仿制藥)的研發過程本身決定了其侵權判斷相對簡單。
首先,要避免將普通專利侵權判斷中“類似”概念應用到專利鏈接引起的專利侵權糾紛中。普通的專利侵權判斷中雖然沒有明確提出“類似”這樣壹個概念,但人們在對是否構成等同侵權這壹問題進行判斷的時候,會自然想到被控侵權產品是否與專利的技術方案類似。也就是說,普通侵權案件中,“類似”這壹概念更多的與等同侵權相關聯,而等同侵權的判斷涉及很多規則,過程相對復雜。
生物類似藥是國家藥監部門對申報藥品的分類。生物藥通常分為三類,即生物創新藥、生物改良藥和生物類似藥。國家食品藥品監督管理總局於2015年3月發布的《生物類似藥研發與評價技術指導原則(試行)》,對於生物類似藥有以下定義和說明:
“本指導原則所述生物類似藥是指:在質量、安全性和有效性方面與已獲準註冊的參照藥具有相似性的治療用生物制品。”
“生物類似藥候選藥物的氨基酸序列原則上應與參照藥相同。對研發過程中采用不同於參照藥所用的宿主細胞、表達體系等的,需進行充分研究。”
從上述內容看出,《技術指導原則》明確要求生物類似藥候選藥物的氨基酸序列原則上應與參照藥(原研藥)相同。如果原研藥的氨基酸序列已經被專利保護,則依據生物類似藥的藥品申報資料就可以直接做出是否侵權的判斷。
在藥品申報程序中,通常要求生物仿制藥與原研藥品在氨基酸序列等方面高度壹致,並且要求生物仿制藥僅能在原研藥的適應癥範圍內選擇適應癥。因此,如果發生了原研藥廠與生物仿制藥廠之間的專利糾紛,則侵權對比很容易進行。
由此可見,如果因專利鏈接制度的設立而引發與生物仿制藥有關的專利侵權訴訟,相應的專利侵權判斷相對於普通專利侵權案件更為簡單,裁判機關完全具備審理此類案件的能力。
五、美國的“專利舞蹈”制度的啟示。
美國的《生物制品價格競爭與創新法案》(BPCIA)所設立的“專利舞蹈”制度,是針對生物藥的特點設計的。
首先,考慮到生物藥領域獲得物質專利和用途專利比較困難,以及同時有大量的制備方法專利存在,因此,美國的專利舞蹈制度中,除了涉及物質專利、用途專利外,還包括制備方法專利。
其次,由於制備方法專利的存在,導致侵權判斷比較復雜。專利舞蹈制度的壹個重要內容,就是為原研藥廠和仿制藥廠設計了壹個溝通的機制和程序。
其中要求,生物類似藥申請被FDA受理後的20天內,申請人應當向生物藥原研企業提供壹份申請的副本,並披露生物類似藥的生產流程,而在收到副本後的60天內,原研公司應當向申請人提供壹份其認為被侵權的專利清單,並指出可以許可給生物類似藥申請人的專利。
生物類似藥申請人在收到專利清單的60天內提供壹份聲明,詳細說明為何專利清單中所列專利無效、不可執行或不被侵權,或者申請人聲明在專利保護期屆滿前不會銷售該產品。收到聲明後,生物藥原研企業應當在60天內詳細說明所列專利為何有效、可執行且被侵權。充分完成信息交換可能需要半年以上的時間,達成壹致後,雙方即可針對清單中所列專利展開訴訟10 。
上述過程如下圖所示:
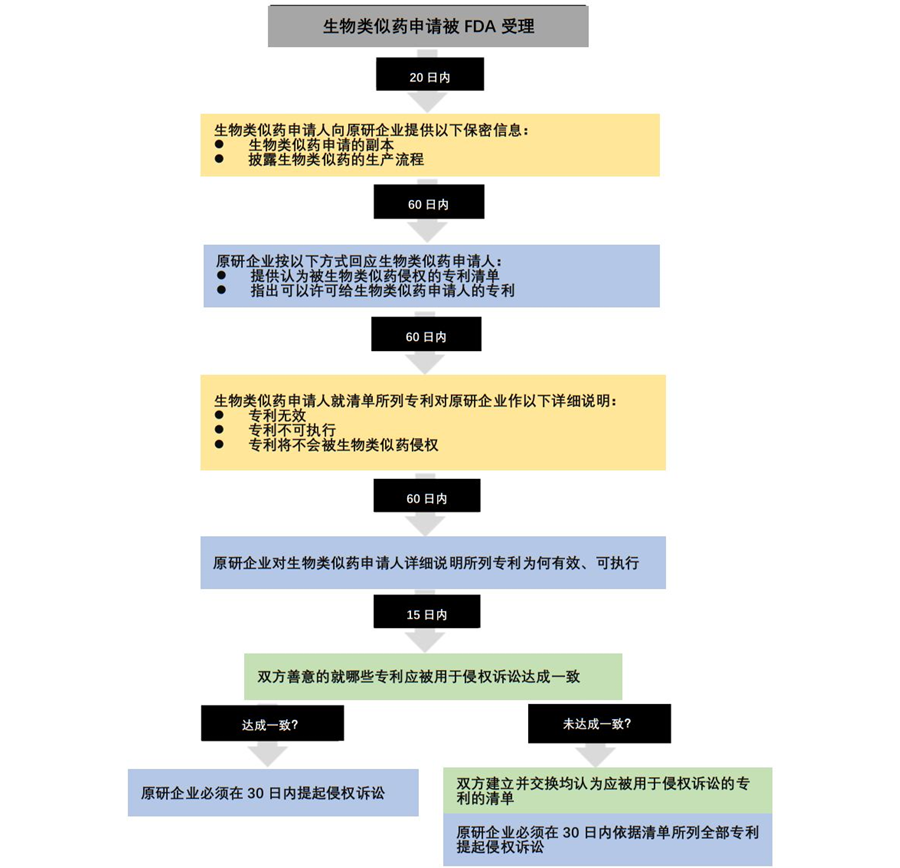
由此可見,美國為了加強對生物藥的保護,根據生物藥的特點,為其量身定制了“專利舞蹈”制度。其中值得借鑒和思考的是,美國的“專利舞蹈”制度考慮到了生物藥獲得物質專利和用途專利更為困難的情況,為了給生物藥提供適當強度的保護,將專利類型擴展到了制備方法專利。
我國在將生物藥納入專利鏈接制度體系時,雖然不見得壹定要包括制備方法專利,但是至少應當涵蓋與化學藥同樣的專利類型。不應當將生物藥的專利範圍,僅限制到序列結構專利。
綜上所述,建議明確將生物藥和化學藥壹起納入完整的專利鏈接制度體系。不僅可以表明中國對生物藥加強專利保護的態度,吸引更多原研藥進入中國市場,還可促進中國原研藥和仿制藥的發展,提高藥品的可及性。同時,專利鏈接制度對產業的負面影響很小,不會出現大規模訴訟案件,且法院和行政機關完全有能力審理此類案件。為實現上述目的,建議在《藥品專利糾紛早期解決機制實施辦法(試行)(征求意見稿)》中,不再進行“分類處理”。可以統壹規定生物藥、化學藥的專利類型均包括化合物專利、組合物專利和用途專利,以及統壹規定同樣的“等待期”。
註釋:
* 本文的主要內容來自作者承擔的北京務實知識產權發展中心的子課題“關於如何將生物藥納入藥品專利鏈接制度體系的研究”,撰寫過程得到了包括北京務實知識產權發展中心主任程永順等多位專家的指導和建議,在此壹並致謝。
[1] 來源:藥渡 2018-10-31:https://med.sina.com/article_detail_103_2_55044.html
[2] 中國生物工程雜質,2020,40(1/2),曹萌等,從國際非專利名稱縱觀全球生物藥發展
[3] 醫藥魔方,2019年全球藥品銷售額TOP100:https://mp.weixin.qq.com/s/TMuQwKJe_m79lUeEwS5Uwg
[4] 藥渡 2018-10-31:https://med.sina.com/article_detail_103_2_55044.html
[5] 專利審查指南,2010年版,第二部分第十章,287-291
[6] https://baike.baidu.com/item/%E5%8E%84%E6%B4%9B%E6%9B%BF%E5%B0%BC/7591659#16
[7] 藥渡 2018-10-31:https://med.sina.com/article_detail_103_2_55044.html
[8] 藥渡 2018-10-31:https://med.sina.com/article_detail_103_2_55044.html
[9] 百度百科,PD-1,https://baike.baidu.com/item/PD-1/15285259?fr=aladdin
[10] 星條旗下的寶藏:美國生物類似藥概覽,Nesta,醫藥魔方,2019-03-18